Перейти к:
Разработка метода получения наноразмерного карбоната магния, стабилизированного хитозаном, как основы скаффолд-матриксов для регенеративной медицины
https://doi.org/10.23947/2687-1653-2024-24-4-392-401
EDN: KXALAI
Аннотация
Введение. В открытом доступе достаточно литературы о методах лечения опорно-двигательного аппарата. Описаны возможности устранения дефектов кости с использованием собственных (аутологичных) костей пациентов. Авторы теоретических и прикладных исследований предлагают применять также синтетические биоинертные материалы из полимеров, фосфатов кальция, пластмасс, металлов. Изучено создание на основе скаффолдов трехмерных матриц для формирования систем, по структуре максимально близких костной ткани. Известно, что действующими веществами скаффолд-матрицы могут быть гидроксиапатит, трикальций фосфат, а также силикаты, карбонаты магния, кальция, меди, цинка и марганца. Вопрос нуждается в детальной проработке. В свете заявленной проблемы особенности перечисленных материалов следует изучать по отдельности. Таких публикаций нет. Представленная работа призвана восполнить данный пробел. Ее цель — создание метода синтеза и исследование свойств наноразмерного карбоната магния.
Материалы и методы. Материалами для исследования послужили образцы наночастиц карбоната магния, полученные химическим осаждением в воде. Их изучали методами рентгеновской дифрактометрии, сканирующей электронной микроскопии, инфракрасной спектроскопии и динамического рассеяния света. Квантово-химическое моделирование проводили при помощи программы QChem и молекулярного редактора IQmol.
Результаты исследования. Установлено, что частицы карбоната магния — стержнеобразные, длиной от 2 до 10 мкм. Они состоят из наночастиц от 30 до 60 нм. Благодаря квантово-химическому моделированию выявлены энергетические особенности взаимодействия основного карбоната магния, во-первых, с хитозаном с карбонатом, а во-вторых, с отдельной молекулой хитозана. В первом случае значение энергии ниже, во втором — выше. Это указывает на химическую и энергетическую выгоду образования таких комплексов. Определены соответствующие показатели для оптимального варианта координирования карбоната магния с хитозаном. В этом случае взаимодействие обеспечивает гидроксильная группа хитозана, присоединенная к C6 остатку глюкозамина. Для данного процесса отмечена самая низкая энергия ∆E = 462,387 ккал/моль и химическая жесткость η = 0,062 эВ. Наночастицы карбоната магния обладают оптимальными радиусом и дзета-потенциалом при следующих параметрах исходных реагентов: 0,018 моль карбоната аммония, 0,03 моль ацетата магния, 0,15 г хитозана.
Обсуждение и заключение. Полученные данные свидетельствуют о том, что наноразмерный основной карбонат магния — это перспективный материал с широкими возможностями практического применения. С этой точки зрения особый интерес представляет его роль в процессах обмена, а именно в усвоении макронутриентов. Синтезированный в среде биополимера наноразмерный остеотропный микронутриент магния можно использовать как биологически активный наполнитель трехмерных скаффолд-матриксов. Реализация данного решения в медицинской практике позволит повысить эффективность восстановления костной ткани.
Ключевые слова
Для цитирования:
Блинов А.В., Рехман З.А., Гвозденко А.А., Ясная М.А., Колодкин М.А., Тараванов М.А. Разработка метода получения наноразмерного карбоната магния, стабилизированного хитозаном, как основы скаффолд-матриксов для регенеративной медицины. Advanced Engineering Research (Rostov-on-Don). 2024;24(4):392-401. https://doi.org/10.23947/2687-1653-2024-24-4-392-401. EDN: KXALAI
For citation:
Blinov A.V., Rekhman Z.A., Gvozdenko A.A., Yasnaya M.A., Kolodkin M.A., Taravanov M.A. Development of a Method for Obtaining Nanoscale Magnesium Carbonate Stabilized with Chitosan as the Basis of Scaffold Matrices for Regenerative Medicine. Advanced Engineering Research (Rostov-on-Don). 2024;24(4):392-401. https://doi.org/10.23947/2687-1653-2024-24-4-392-401. EDN: KXALAI
Введение. Регенеративной медицине постоянно требуются материалы, которые способствуют ускорению регенерации костной ткани [1]. Даже с появлением новых решений проблема сохраняет актуальность, т. к. переломы — очень распространенный вид травм [2]. Отметим, что пациенты полностью восстанавливаются лишь в 16 % случаев. По данным Всемирной организации здравоохранения, в мире фиксируется порядка 50 млн тяжелых травм, которые приводят к потере трудоспособности и инвалидности. Поэтому лечение дефектов костных тканей — актуальная медицинская и социальная проблема [3]. Чтобы помочь пациенту, используют трехмерные биополимерные матрицы на основе скаффолдов. Они содержат элементы, близкие по структуре к соединительной костной ткани. Один из таких материалов для регенеративной медицины — наноразмерные формы карбоната магния [4]. Магний — это эссенциальный микроэлемент [5]. Он отвечает за крепость костей [6] и участвует в их формировании [7]. На его основе создаются ортопедические имплантаты [8]. В наноразмерной форме карбонат магния обладает такими свойствами, как:
- низкая токсичность;
- хорошая биосовместимость;
- проницаемость для лекарственных средств [9].
В биологических взаимодействиях важную роль играют шероховатость и химический состав поверхности элементов [10]. Будущие материалы на основе соединений в нанометровом диапазоне могут в конечном итоге изменить природу тканей вокруг имплантата и повысить клиническую успешность такого подхода [11]. Для улучшения названных выше свойств применяют биополимеры. Один из них — хитозан [12]. Это важный биосовместимый компонент соединительной ткани. Он хорошо растворяется и разлагается [13].
Основная цель данного исследования — создание метода синтеза стабилизированного хитозаном наноразмерного карбоната магния, а также исследование его свойств. Материал рассматривается как основа скаффолд-матриксов для регенеративной медицины.
Материалы и методы. Методом химического осаждения наночастицы карбоната магния синтезировали из магнийсодержащего прекурсора — ацетата магния. Осадителем был карбонат аммония, стабилизатором — полисахарид хитозан. На первом этапе в раствор ацетата магния добавляли необходимый объем 1 % раствора хитозана. Далее с помощью капельной воронки при постоянном перемешивании в раствор прекурсора вводили раствор осадителя со скоростью 60 капель в минуту. После введения всего раствора осадителя полученный золь перемешивали еще 10 минут. Синтезированный золь прокрутили в центрифуге, а затем высушили в сушильном шкафу. Так получили образцы порошка карбоната магния. Их фазовый состав исследовали с помощью метода порошковой дифрактометрии на приборе Empyrean (производитель PANalytical, Нидерланды) при следующих параметрах измерений:
- медный катод (длина волны излучения — 1,54 Å);
- диапазон измерения — 10–90о 2θ;
- частота дискретизации — 0,01о 2θ.
Микроструктуру образцов карбоната магния исследовали с помощью сканирующего электронного микроскопа MIRA3-LMH (Tescan, Чехия).
Для подготовки проб двухсторонний проводящий углеродный скотч помещали на приборный столик (12 мм), наносили порошок исследуемого материала и углеродный слой толщиной 10 нм. Параметры измерения:
- ускоряющее напряжение — 10 кВ;
- значение фокусного расстояния — 4,9 мм;
- детектор In-Beam SE.
Для компьютерного квантово-химического моделирования карбоната магния при взаимодействии с хитозаном использовали программное обеспечение QChem. Для исследования выбрали метод Хартри — Фока и базисный набор 6–31G1. Для конфигурации молекул задействовали молекулярный редактор IQmol [14]. Образцы исследовали методом инфракрасной (ИК) спектроскопии. С этой целью применили ИК-спектрометр с Фурье-преобразованием. Модель ФСМ 1201 (Россия).
Порошки MgCO3 и KBr тщательно смешивали в соотношении 1:300 и прессовали в виде таблетки в специальной пресс-форме под давлением 500–1 000 МПа. Полученные образцы помещали в спектрометр и проводили измерения в пределах — 400–4 400 см–1.
Методом динамического рассеяния света на приборе Photocor complex (Россия) исследовали средний гидродинамический радиус наночастиц карбоната магния, стабилизированных хитозаном. Их ζ-потенциал оценивали с помощью метода акустической и электроакустической спектроскопии на спектрометре DT–1202 (Dispersion Technology Inc., США).
Метод получения наночастиц карбоната магния оптимизировали с помощью многофакторного эксперимента. Для этого использовали параметры:
- три переменных (содержание ацетата магния, карбоната аммония и хитозана);
- два выходных (средний гидродинамический радиус и дзета-потенциал) [15].
Данные обработали с помощью программы Statistica 10.0. Уровни варьирования представлены в таблице 1.
Таблица 1
Уровни варьирования переменных
|
Наименование параметров |
Уровни варьирования переменных |
||
|
Содержание ацетата магния, моль |
0,012 |
0,024 |
0,030 |
|
Содержание карбоната аммония, моль |
0,012 |
0,024 |
0,030 |
|
Масса хитозана, г |
0,150 |
0,300 |
0,450 |
Далее строили матрицу планирования эксперимента (таблица 2).
Таблица 2
Матрица планирования эксперимента
|
№ |
Объем 0,8 М раствора ацетата магния, мл |
Объем 0,8 М раствора карбоната аммония, мл |
Объем раствора хитозана, мл |
|
1 |
15 |
15 |
15 |
|
2 |
15 |
30 |
30 |
|
3 |
15 |
45 |
45 |
|
4 |
30 |
15 |
30 |
|
5 |
30 |
30 |
45 |
|
6 |
30 |
45 |
15 |
|
7 |
45 |
15 |
45 |
|
8 |
45 |
30 |
15 |
|
9 |
45 |
45 |
30 |
Результаты исследования. На первом этапе изучили фазовый состав полученных образцов. Результаты представлены на рис. 1.
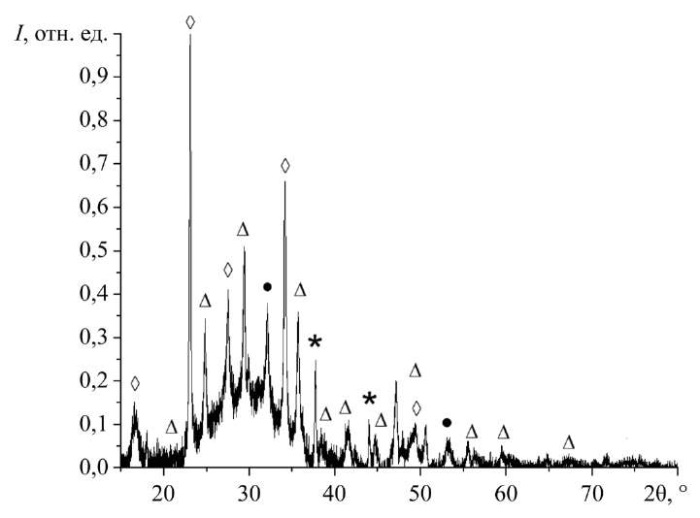
Рис. 1. Дифрактограмма образца наноразмерного карбоната магния, стабилизированного хитозаном. Здесь ● — MgCO3, ◊ — Mg2(CO3)(OH)2 3H2O, ∆ — MgCO3 · 5H2O,* — MgO
Далее при помощи сканирующего электронного микроскопа (СЭМ) исследовали микроструктуру полученных образцов наночастиц карбоната магния, стабилизированных хитозаном (рис. 2).

Рис. 2. СЭМ-микрофотографии образца наночастиц карбоната магния, стабилизированных хитозаном: а — увеличение в 20 000 раз; б — увеличение в 160 000 раз
Для исследования способа координирования наночастиц карбоната магния с хитозаном проводили квантово-химическое моделирование молекулярных структур карбоната магния с хитозаном. Результаты показаны в таблице 3 и на рис. 3, 4. Здесь HOMO — высшая заселенная молекулярная орбиталь, LUMO — низшая свободная молекулярная орбиталь.
Таблица 3
Результаты квантово-химических расчетов молекулярных структур карбоната магния и основного карбоната магния с хитозаном
|
Взаимодействие |
Тип соединения магния |
E, ккал/моль |
∆E, ккал/моль |
EHOMO, эВ |
ELUMO, эВ |
η, эВ |
|
Мономерное звено хитозана |
– |
–1 258,049 |
– |
–0,225 |
0,030 |
0,128 |
|
Через гидроксильную группу, которая присоединена к C6 остатку глюкозамина |
MgCO3 |
–1 720,436 |
462,387 |
–0,161 |
–0,037 |
0,062 |
|
Mg(OH)2CO3 |
–1 994,103 |
736,054 |
–0,179 |
–0,111 |
0,034 |
|
|
Через гидроксильную группу, которая присоединена к C3 остатку глюкозамина |
MgCO3 |
–1 720,366 |
462,317 |
–0,167 |
–0,042 |
0,063 |
|
Mg(OH)2CO3 |
–1 994,273 |
736,224 |
–0,182 |
–0,064 |
0,059 |
|
|
Через аминогруппу, которая присоединена к C2 остатку глюкозамина |
MgCO3 |
–1 720,418 |
462,369 |
–0,124 |
–0,019 |
0,053 |
|
Mg(OH)2CO3 |
–1 994,104 |
736,055 |
–0,156 |
–0,048 |
0,054 |
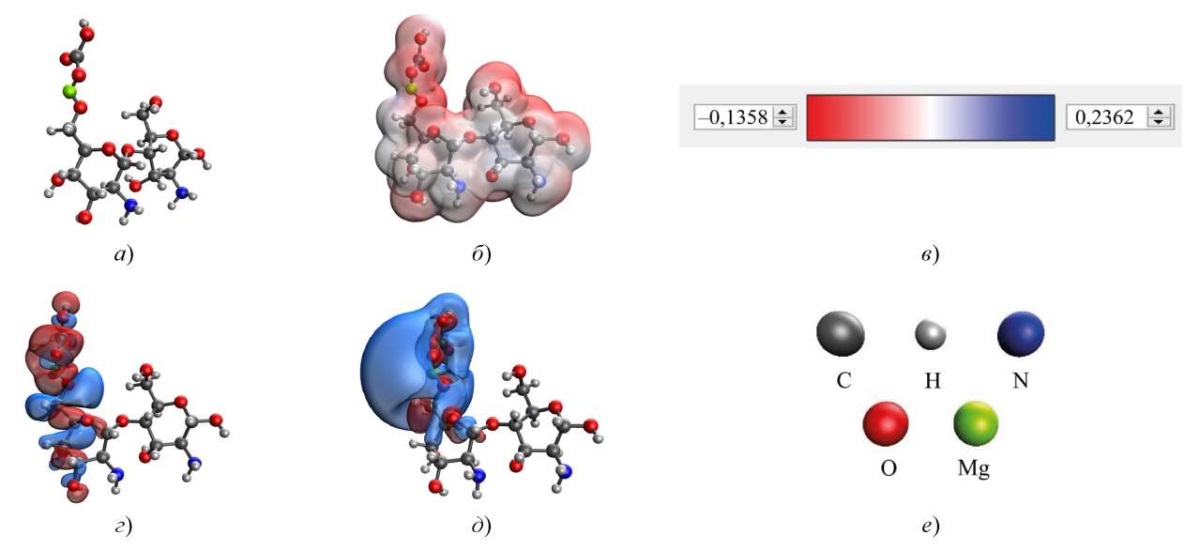
Рис. 3. Результаты моделирования взаимодействия хитозана с карбонатом магния через гидроксильную группу, присоединенную к C6 остатку глюкозамина в хитозане: а — модель комплекса; б — распределение электронной плотности; в — градиент распределения электронной плотности; г — HOMO; д — LUMO; е — расшифровка атомов
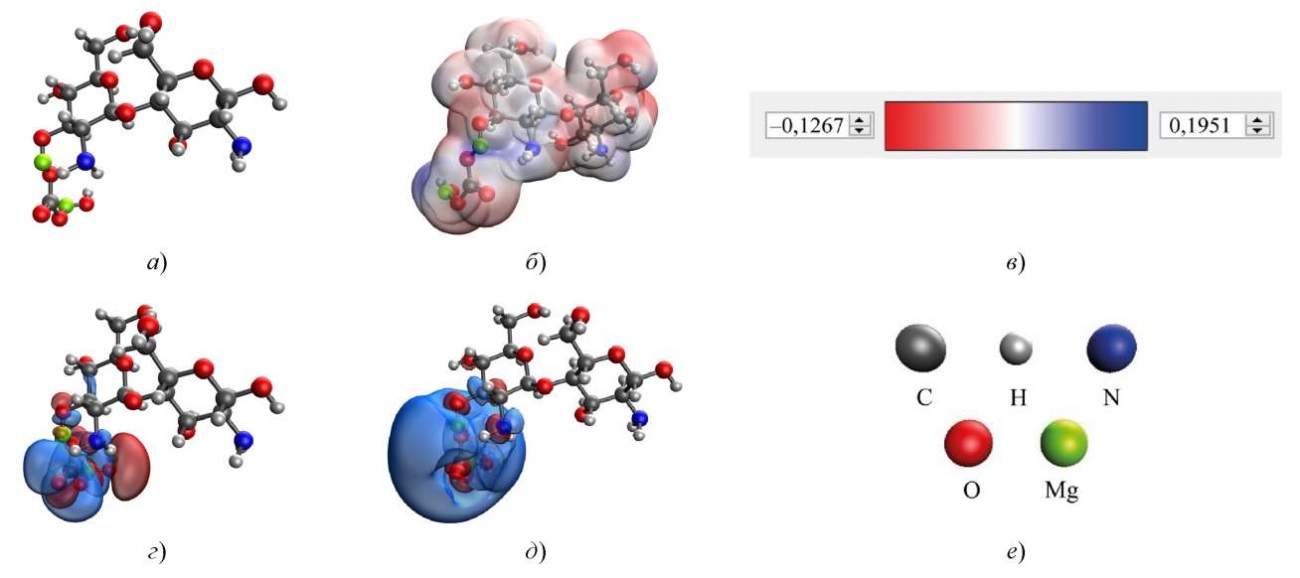
Рис. 4. Результаты моделирования взаимодействия хитозана с основным карбонатом магния через гидроксильную группу, присоединенную к C3 остатку глюкозамина в хитозане: а — модель комплекса; б — распределение электронной плотности; в — градиент распределения электронной плотности; г — HOMO; д — LUMO; е — расшифровка атомов
Для подтверждения данных квантово-химического моделирования образцы исследовались методом инфракрасной спектроскопии. Результаты представлены на рис. 5.
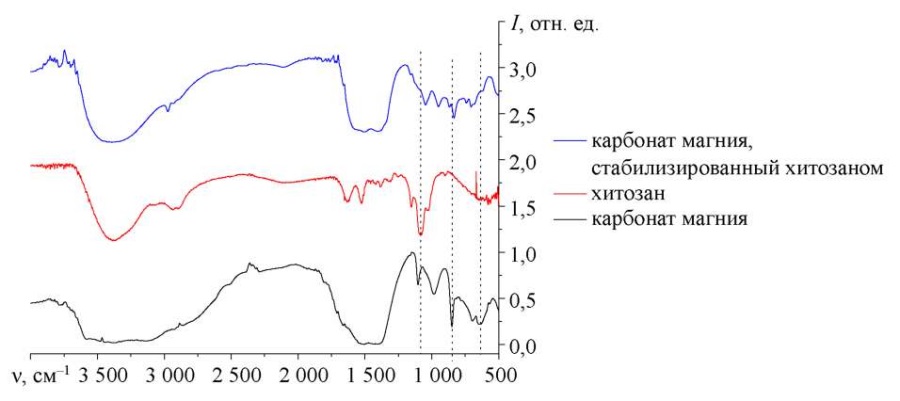
Рис. 5. ИК-спектр наночастиц карбоната магния, стабилизированных хитозаном
Для изучения влияния входных параметров на синтез наноразмерного карбоната магния формировали тернарные зависимости. На рис. 6 представлена зависимость среднего гидродинамического радиуса наночастиц от содержания исходных реагентов.
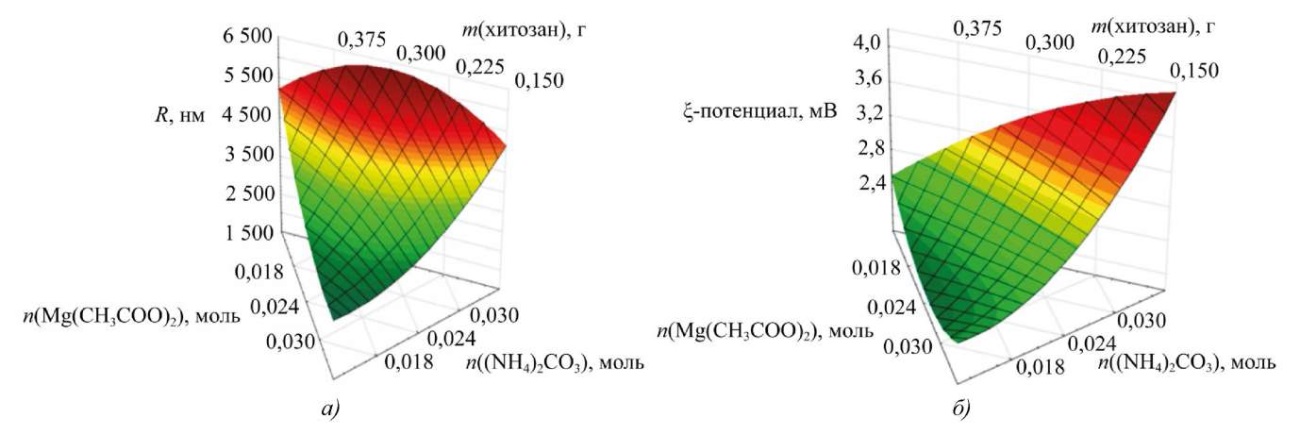
Рис. 6. Зависимости изменения среднего гидродинамического радиуса и электрокинетического потенциала от концентраций исходных реагентов: а — тернарная поверхность, описывающая влияние исходных реагентов на размер частиц карбоната магния; б — тернарная поверхность, описывающая влияние исходных реагентов на электрокинетический потенциал частиц карбоната магния
Анализ фазового состава образцов показал, что присутствуют фазы карбоната магния безводного (MgCO3), две конфигурации карбоната магния в виде кристаллогидрата (MgCO3 · 5H2O), Mg2(CO3)(OH)2 · 3H2O и оксида магния (MgO).
При анализе микроструктуры поверхности наночастиц карбоната магния установлено, что образец обладает анизотропной формой. Карбонат магния представлен стержнеобразными частицами длиной от 2 до 10 мкм, которые состоят из наночастиц размером от 30 до 60 нм.
Компьютерное квантово-химическое моделирование позволило сравнить энергию при взаимодействии с основным карбонатом магния:
- хитозана с карбонатом;
- отдельной молекулы хитозана.
В первом случае значение энергии будет ниже, чем во втором. Это указывает на химическую и энергетическую выгоду образования таких комплексов (для карбоната магния энергия взаимодействия более 462,00 ккал/моль, а для основного карбоната — более 736,00 ккал/моль).
В оптимальном варианте координирования карбоната магния с хитозаном взаимодействие происходит через гидроксильную группу хитозана, присоединенную к C6 остатку глюкозамина. Данное взаимодействие имеет самую низкую энергию ∆E = 462,387 ккал/моль и химическую жесткость η = 0,062 эВ.
Положение функциональных групп определяли по ИК-спектроскопии наночастиц карбоната магния, стабилизированных хитозаном. Дополнительно фиксировали спектры чистого хитозана и карбоната магния. Анализ ИК-спектра карбоната магния показал, что в области от 2 200 до 3 000 см–1 находятся валентные колебания групп NH3+, NH2+, NH+ и CH2, –CH3. Полосы на 988 см–1, 1 102 см–1, 1 414 см–1 и 1 529 см–1 связаны с колебаниями C–O и C=O в группе CO32 [16]. Полоса на 620 см–1 соответствует колебаниям гидроксильной группы, а полосы на 698 и 852 см–1 обусловлены колебаниями связи Mg–O [17].
Анализ ИК-спектров хитозана показал, что область от 2 500 до 3 400 см–1 отвечает за валентные колебания следующих функциональных групп: –OH, –CH3, CH2 [18]. Область от 1 000 до 1900 см–1 характеризует колебания связей C–O, C–O–C, –CH2, –CH3, C–N, NH2+ [19]. Область полос от 500 до 900 см–1 относится к деформационным колебаниям: на 898 см–1 — связи C–H [20], на 581, 652, 704 и 768 см–1 — связей –CH и –CH2.
Как показал анализ образца наночастиц карбоната магния, стабилизированных хитозаном, в диапазоне от 2100 до 3000 см–1 находятся валентные колебания групп NH3+, NH2+, NH+, –CH3, CH2, O–H. Это характерно для молекулы хитозана. Также присутствуют полосы на 1414 см–1 и 1529 см–1, которые соответствуют колебаниям C–O и C=O в группе CO32, что подтверждает наличие функциональных групп карбоната магния в системе [21]. Связывание магния подтверждается наличием деформационных колебаний C–O и C=O в группе CO32– и колебаний связи Mg–O и CO32– в диапазоне от 700 до 1 100 см–1 [22].
Отмечается уменьшение интенсивности пиков на 620 см–1 и 1 078 см–1, которые соответствуют колебаниям O–H и C–O групп. Это указывает на взаимодействие карбоната магния и хитозана через гидроксильные группы и согласуется с результатами квантово-химического моделирования.
Изучение полученных тернарных поверхностей приводит к выводу, что изменение соотношения между ацетатом магния и карбонатом аммония заметно влияет на размер и дзета-потенциал частиц карбоната магния. Средний гидродинамический радиус частиц не зависит от содержания хитозана. Однако изменение дзета-потенциала связано с содержанием стабилизатора и концентрацией осадителя, что важно для оценки стабильности наноразмерных систем. В результате были выбраны параметры исходных реагентов, при которых образец наночастиц карбоната магния обладает оптимальными радиусом и дзета-потенциалом:
- 0,018 моль карбоната аммония;
- 0,03 моль ацетата магния;
- 0,15 г хитозана.
Обсуждение и заключение. Магний в составе карбоната магния необходим для нормального функционирования организма. В процессах обмена он обеспечивает эффективное усвоение макронутриентов. Это позволяет говорить об актуальности и потенциальной востребованности метода получения наноразмерного карбоната магния, стабилизированного хитозаном. Данный подход разработан и оптимизирован в рамках представленной научной работы. Установлено, что наночастицы карбоната магния представляют собой агломераты стержнеобразной формы длиной от 2 до 10 мкм. Эти скопления состоят из наночастиц размером от 30 до 60 нм. Оптимальный способ координирования молекул — взаимодействие карбоната магния через гидроксильную группу в C6 остатке глюкозамина в молекуле хитозана. Преимущество обеспечивается значительными показателями энергии и химической жесткости.
ИК-спектроскопия образцов наночастиц карбоната магния, стабилизированных хитозаном, выявила падение интенсивности полос, которые характеризуют колебания O–H группы (для карбоната магния) и колебания группы C–O (для хитозана). Из этого следует, что взаимодействие происходит через гидроксильные группы хитозана.
Выполненная в рамках представленной работы оптимизация метода синтеза наночастиц карбоната магния, стабилизированных хитозаном, позволяет сделать ряд утверждений.
- При увеличении содержания ацетата магния уменьшаются размер частиц и электрокинетический потенциал наноразмерного карбоната магния.
- При увеличении концентрации карбоната аммония растет средний гидродинамический радиус и заряд поверхности наночастиц карбоната магния.
- Концентрация хитозана незначительно виляет на радиус частиц, однако при увеличении его содержания уменьшается заряд поверхности.
1. Здесь 6–31G — базисный набор, который использовался в данном исследовании. STO-nG — это семейство базисных наборов орбиталей слейтеровского типа.
Список литературы
1. Канев А.А., Кураков Ф.А., Черченко О.В., Цветкова Л.А. Развитие регенеративной медицины в России и в мире: исследователи-лидеры и технологические драйверы. Экономика науки. 2022;8(3/4):202–219. https://doi.org/10.22394/2410–132X–2022–8–3–4–202–219
2. Safronova TV. Inorganic Materials for Regenerative Medicine. Inorganic Materials. 2021;57(5):443–474. https://doi.org/10.1134/S002016852105006X
3. Агазаде А.Р., Агазаде Р.Р., Гергиева Т.Ф., Амхадов И.С., Кадиев А.А., Мамедов С.Э. и др. Оценка эффективности лечения и мониторинга пациентов с системными нарушениями костной ткани при проведении дентальной имплантации. Медицинский алфавит. 2023;1(1):44–49. https://doi.org/10.33667/2078–5631–2023–1–44–49
4. Голубева А.Н. Правильное питание как основная составляющая здорового образа жизни человека. Международный журнал гуманитарных и естественных наук. 2023;786(1–4):40–42. https://doi.org/10.24412/2500–1000–2023–1–4–40–42
5. Погожева А.В., Коденцова В.М., Шарафетдинов Х.Х. Роль магния и калия в профилактическом и лечебном питании. Вопросы питания. 2022;91(5):29–42. https://doi.org/10.33029/0042–8833–2022–91–5–29–42
6. Кочнева Е.В. Дефицит магния в клинической практике. Вопросы диетологии. 2018;8(1):37–51. https://doi.org/10.20953/2224–5448–2018–1–37–51
7. Евсеева Г.П., Супрун С.В., Супрун Е.Н., Ракицкая Е.В., Козлов В.К., Лебедько О.А. Влияние дисбаланса микроэлементов на иммунитет. Микроэлементы в медицине. 2021;22(S1):27–28. https://doi.org/10.19112/2413-6174-2021-S1-12
8. Hang Zhou, Bing Liang, Haitao Jiang, Zhongliang Deng, Kexiao Yu. Magnesium-Based Biomaterials as Emerging Agents for Bone Repair and Regeneration: From Mechanism to Application. Journal of Magnesium and Alloys. 2021;9(3): 779–804. URL: https://www.jmamg.com/uploadfiles/2024/04/20240407095328708.pdf (accessed: 25.06.2024).
9. Рубникович С.П., Хомич И.С. Костные трансплантаты и заменители для устранения дефектов и аугментации челюстных костей в имплантологии и периодонтологии. Стоматолог. 2014;1(12):77–86. URL: http://journal-stomatolog.by/wp-content/uploads/2018/05/2–13–2014.pdf (дата обращения: 25.06.2024).
10. Монич С.Г., Храмкова А.С., Бондаренко В.А. Использование нанотехнологий в дентальной имплантологии. В: Тр. 16-й Междунар. науч.-тех. конф. «Приборостроение-2023». Минск: Белорусский национальный технический университет; 2023. С. 288–289. URL: https://rep.bntu.by/bitstream/handle/data/138532/288289.pdf?sequence=1&isAllowed=y&ysclid=lw7sq5m32n354587227 (дата обращения: 25.06.2024).
11. Волова Л.Т., Трунин Д.А., Пономарева Ю.В., Попов Н.В. Исследование биосовместимости и цитотоксичности персонифицированных костных имплантатов с применением клеточных технологий. Вестник медицинского института «Реавиз»: реабилитация, врач и здоровье. 2017;29(5):32–39.
12. Kou Sh(G), Peters L, Mucalo M. Chitosan: A Review of Molecular Structure, Bioactivities and Interactions with the Human Body and Micro-Organisms. Carbohydrate Polymers. 2022;282:119132. https://doi.org/10.1016/j.carbpol.2022.119132
13. Wenjie Wang, Changhu Xue, Xiangzhao Mao. Chitosan: Structural Modification, Biological Activity and Application. International Journal of Biological Macromolecules. 2020;164:4532–4546. https://doi.org/10.1016/j.ijbiomac.2020.09.042
14. Блинов А.В., Пирогов М.А., Гвозденко А.А., Голик А.Б., Рехман З.А., Колодкин М.А. и др. Компьютерное квантово-химическое моделирование взаимодействия наночастиц селена с четвертичными аммониевыми соединениями. Физико-химические аспекты изучения кластеров, наноструктур и наноматериалов. 2023;15:357–366. https://doi.org/10.26456/pcascnn/2023.15.357
15. Анисимов А.В. Планирование эксперимента как эффективный метод оптимизации технологического процесса. В: Тр. Междунар. науч.-практ. конф. «Актуальные проблемы ветеринарной медицины, пищевых и биотехнологий». Саратов: Саратовский государственный аграрный университет им. Н.И. Вавилова; 2022. С. 249–252.
16. Frost RL. Raman Spectroscopic Study of the Magnesium Carbonate Mineral Hydromagnesite (Mg5[(CO3)4 OH)2]·4H2O). Journal of Raman Spectroscopy. 2011;42(8):1690–1694. https://doi.org/10.1002/jrs.2917
17. Kornprobst T, Plank J. Synthesis and Properties of Magnesium Carbonate Xerogels and Aerogels. Journal of Non-Crystalline Solids. 2013;361:100–105. https://doi.org/10.1016/j.jnoncrysol.2012.10.023
18. Aksay S. Effects of Al Dopant on XRD, FT-IR and UV–vis Properties of MgO Films. Physica B: Condensed Matter. 2019;570:280–284. https://doi.org/10.1016/j.physb.2019.06.020
19. Apfelbaum F, Mayer I, Rey C, Lebugle A. Magnesium in Maturing Synthetic Apatite: A Fourier Transform Infrared Analysis. Journal of Crystal Growth. 1994;144(3-4):304–310. https://doi.org/10.1016/0022–0248(94)90471–5
20. Frost RL, Reddy BJ, Bahfenne S, Graham J. Mid-Infrared and Near-Infrared Spectroscopic Study of Selected Magnesium Carbonate Minerals Containing Ferric Iron – Implications for the Geosequestration of Greenhouse Gases. Spectrochimica Acta. Part A: Molecular and Biomolecular Spectroscopy. 2009;72(3):597–604. https://doi.org/10.1016/j.saa.2008.10.043
21. Zawadzki J, Kaczmarek H. Thermal Treatment of Chitosan in Various Conditions. Carbohydrate Polymers. 2010;80(2):394–400. https://doi.org/10.1016/j.carbpol.2009.11.037
22. Silva SML, Braga CRC, Fook MVL, Raposo CMO, Carvalho LH, Canedo EL. Application of infrared spectroscopy to analysis of chitosan/clay nanocomposites. In book: Th Theophanides (ed). Infrared Spectroscopy — Materials Science, Engineering and Technology. Ch. 3. London: IntechOpen Publ.; 2012. P. 43–62. http://doi.org/10.13140/2.1.3806.5609
Об авторах
А. В. БлиновРоссия
Андрей Владимирович Блинов, кандидат технических наук, заведующий кафедрой физики и технологии наноструктур и материалов
355017, г. Ставрополь, ул. Пушкина, 1
З. А. Рехман
Россия
Зафар Абдулович Рехман, ассистент кафедры физики и технологии наноструктур и материалов
355017, г. Ставрополь, ул. Пушкина, 1
А. А. Гвозденко
Россия
Алексей Алексеевич Гвозденко, ассистент кафедры физики и технологии наноструктур и материалов
355017, г. Ставрополь, ул. Пушкина, 1
М. А. Ясная
Россия
Мария Анатольевна Ясная, кандидат химических наук, доцент кафедры физики и технологии наноструктур и материалов
355017, г. Ставрополь, ул. Пушкина, 1
М. А. Колодкин
Россия
Максим Андреевич Колодкин, заведующий лабораторным комплексом кафедры физики и технологии наноструктур и материалов
355017, г. Ставрополь, ул. Пушкина, 1
М. А. Тараванов
Россия
Максим Александрович Тараванов, лаборант кафедры физики и технологии наноструктур и материалов
355017, г. Ставрополь, ул. Пушкина, 1
Рецензия
Для цитирования:
Блинов А.В., Рехман З.А., Гвозденко А.А., Ясная М.А., Колодкин М.А., Тараванов М.А. Разработка метода получения наноразмерного карбоната магния, стабилизированного хитозаном, как основы скаффолд-матриксов для регенеративной медицины. Advanced Engineering Research (Rostov-on-Don). 2024;24(4):392-401. https://doi.org/10.23947/2687-1653-2024-24-4-392-401. EDN: KXALAI
For citation:
Blinov A.V., Rekhman Z.A., Gvozdenko A.A., Yasnaya M.A., Kolodkin M.A., Taravanov M.A. Development of a Method for Obtaining Nanoscale Magnesium Carbonate Stabilized with Chitosan as the Basis of Scaffold Matrices for Regenerative Medicine. Advanced Engineering Research (Rostov-on-Don). 2024;24(4):392-401. https://doi.org/10.23947/2687-1653-2024-24-4-392-401. EDN: KXALAI












































